Los nitratos en la guerra. Parte II. Miel amarga y cuento casi detective.

El siguiente intento de domesticar al demonio de los explosivos se asoció con el uso de derivados de dos derivados del benceno que son muy similares pero, de hecho, completamente diferentes: fenol y tolueno.
historia Los verdaderos derivados nitro de los hidrocarburos, en lugar de los ésteres nitrosos de los alcoholes, comenzaron con un estudio del efecto del ácido nítrico concentrado en los hidrocarburos. Y aunque la interacción del ácido nítrico concentrado con sustancias orgánicas (en particular, con alcanos) no fue un secreto, las condiciones para su aparición y las propiedades de los nitro compuestos permanecieron durante mucho tiempo "terra incognita" para los químicos. El segundo factor que impidió su uso generalizado fue la debilidad de la base de materia prima para su síntesis de gran tonelaje.
No se desperdicia, sino materia prima valiosa.
La situación comenzó a cambiar a fines del siglo XIX. Se relacionó con el desarrollo de los campos petroleros y el problema del uso de residuos de producción de coque. Fue entonces cuando resultó que a veces los desechos peligrosos pueden convertirse repentinamente en las materias primas más valiosas. Al final resultó que, los productos iniciales para la producción de nitro derivados aromáticos están contenidos casi exclusivamente en alquitrán de hulla y se encuentran como un subproducto de la producción de gas luminoso.
Antes de extraer las sustancias necesarias, el alquitrán de hulla se sometió a un procesamiento primario in situ, como resultado de lo cual se obtuvieron cuatro fracciones principales: aceite ligero, medio o aceite fenólico, aceite pesado y aceite de antraceno. El más valioso es el aceite liviano, que es aproximadamente 4% de la resina total. En la destilación secundaria, se obtienen benceno (aproximadamente 0,8%), tolueno (aproximadamente 1,7%) y fenol (0,4%). Además, el fenol se obtiene sintéticamente del benceno y la lixiviación de las aguas de resina de alquitrán de la producción de coque.
Entonces, el primer paso fue dado. Pero luego, la historia de la producción de dos explosivos principales de esa época comenzó a parecerse a una historia de detectives bastante compleja, en la que los actores y participantes, en las mejores tradiciones del género, crearon una niebla y propusieron una variedad de nombres en clave.
Pintura explosiva (ácido picrico)
Es difícil decir quién y cuándo recibió ácido pícrico por primera vez. Hace muchos siglos, se observó que cuando se aplicaba el espíritu de nitrato (ácido nítrico) a muchos compuestos orgánicos, se formaba un tinte amarillo. Por lo general, el honor de recibir ácido pícrico se atribuye al inglés Wulf, quien en la Royal Society de Londres en 1771 informó que con la ayuda de índigo tratado con ácido nítrico, es posible teñir los tejidos de color amarillo (primero se llamó "sustancia amarilla", y solo entonces obtuvo su nombre de la raíz griega "picros" - "amargo"). Sin embargo, las sales de ácido pícrico eran conocidas un siglo antes por Johann Glauber. A veces se argumenta que el ácido pícrico supuestamente se consideró un tinte inofensivo durante mucho tiempo, y solo muchos años después se descubrieron por casualidad sus propiedades explosivas, pero esto no es así: ya en 1799, el científico francés Welter señaló la capacidad del ácido pícrico para explotar completamente sin ambigüedades.
Es cierto que no explotó tan fácilmente, y por lo tanto, durante mucho tiempo, los investigadores de pikrinki estudiaron obstinadamente su otra característica más relevante para ese momento: la capacidad de ser una pintura duradera y asequible para tejidos de seda y lana. Y se salieron con la suya: durante casi cien años, las mujeres de moda y las fashionistas de París, Londres y otras ciudades lucieron hermosos vestidos amarillos.
Y después, el trueno golpeó.
Es cierto, golpeó de inmediato. Al principio hubo una invención de NNZinin del método industrial para la síntesis de anilina, que abrió el camino a los tintes sintéticos baratos. Luego, los círculos militares de uno de los estados de Europa, Francia, llamaron la atención sobre las auténticas madrigueras del ácido pícrico e incluso comenzaron a utilizarlo como una carga explosiva de municiones de artillería. Luego, en 1873, H. Sprengel (curiosamente, "Sprengen" en alemán significa "explotar", pero en este caso es una mera coincidencia) abrió la capacidad del ácido pícrico para explotar desde el destructor de la cápsula, previamente inventado por Nobel, y para ella al instante. Había un nuevo uso: ella comenzó a equipar las conchas.
La reacción de quemar ácido pícrico en un volumen cerrado se ve así:
Comience a contar el uso del ácido pícrico ya que BB puede ser con 1886 G. En Francia, se usó bajo el nombre melinitaen inglaterra plomoen italia perthiteen japon shimoze.
En ese momento, el ácido pícrico era el más fuerte y, a pesar de las fallas obvias, los explosivos explosivos más comunes. Sin embargo, el volumen de producción de ácido pícrico a principios del siglo XX. comenzó a disminuir debido a sus propiedades negativas, como la interacción con la cubierta del proyectil, lo que lleva a la formación de una alta sensibilidad al picrato de hierro y no es adecuada para la preparación de amonitas. Quizás TNT hubiera reemplazado al picrick si no hubiera sido por la guerra mundial que había estallado. La tecnología depurada ha permitido el lanzamiento de shells en grandes cantidades [15].
El ácido pícrico, por extraño que parezca, fue el primero en la historia en estar seguro al disparar un explosivo. Conchas americanas durante mucho tiempo atendidos exclusivamente "picrinka".
1. Sensibilidad: cuando se prueba con una carga de 10 kg y la altura de caída de 25, consulte el número de explosiones de 24-32%.
2. Energía de transformación explosiva - 4020 kJ / kg.
3. Velocidad de golpe: 7350 m / s.
4. Brizantnost: 17 mm.
5. Explosividad: cubo 310 ver
Sobre la sensibilidad del ácido pícrico se debe decir por separado. Por sí solo, no tiene una sensibilidad muy alta, lo que atrajo la atención (especialmente en el contexto de la trinitroglicerina). Sin embargo, la palabra "ácido" en su nombre no es solo un tributo a la afiliación química de esta sustancia. El hecho es que, en comparación con el fenol progenitor, “picrinka” tiene una tasa de disociación relativamente alta. Sin entrar en detalles de la teoría de la disociación electrolítica y el equilibrio en las soluciones, solo notamos el hecho de que es aproximadamente 1000 veces más fuerte que la acética y 20 más fuerte que el fósforo.
La interacción de un ácido con metales siempre termina de la misma manera: las sales se obtienen, en este caso, picratos. Pero con su sensibilidad a las influencias externas, todo era completamente diferente al de los "picrinks": son extremadamente explosivos, e incluso las sales de sodio y amonio muestran inestabilidad. Qué decir acerca de los picros de hierro: incluso las impurezas menores ya pueden causar la detonación de toda la munición.
Pronto apareció el ácido pícrico ante la Comisión Francesa de Explosivos. Del ojo que todo lo ve de Marcellin Berthelot, quien inició su estudio, nada escapó. Se descubrió que el ácido pícrico es un poderoso agente explosivo, en segundo lugar solo a la nitroglicerina, que no tiene suficiente oxígeno en su composición y que es deseable agregarle algún tipo de oxidante (no solo nitrato); ese ácido pícrico en sí es relativamente seguro, pero cuando se almacena en condiciones inadecuadas, la formación de picratos se acelera por decenas y cientos de veces; que la sensibilidad del ácido pícrico se puede reducir fundiéndolo con dinitronaphthalene. Estos estudios marcaron el comienzo de una revolución completa en las opiniones sobre el ácido pícrico. Finalmente, la desconfianza por el nuevo explosivo fue disipada por el trabajo del químico parisino Eugene Turpen, quien demostró que el ácido pícrico moldeado cambia sus propiedades más allá del reconocimiento en comparación con el polvo prensado y, a veces, pierde su peligrosa sensibilidad.
Ácido picrico fundido, su color ámbar es muy similar al de la miel (en griego, "cardúmenes"), de donde recibió uno de sus nombres.
No hace falta decir que las obras de Turpen fueron estrictamente clasificadas. Y cuando, en los años ochenta, los franceses comenzaron a producir un nuevo explosivo con el misterioso nombre "melinit", despertó gran interés en todos los países. Después de todo, el efecto de choque de las municiones equipadas con melinita inspira el debido respeto incluso en nuestro tiempo. A pesar de todas las precauciones, el secreto de Melinite pronto se convirtió, sin embargo, en un secreto a voces. Ya en 1890, Mendeleev informó al ministro naval ruso Chikhachev:
En 1894, el ácido pícrico se produjo en Rusia. S.Panpushko, un hombre con habilidades sobresalientes y un destino interesante, se ocupó de este problema. Parece que la historia sobre él merece una publicación aparte.
El florecimiento de su producción mundial de ácido pícrico cayó en los años de la Primera Guerra Mundial. Pero en ese momento ella tenía un rival formidable, que rápidamente la presionó tanto en la parte trasera como en la delantera.
Los proyectiles enviados al continente desde los Estados Unidos durante la República Popular China por los primeros transportes, debido a la acción del aire marino, dieron un gran número de explosiones incompletas. Como resultado, los contenidos de las conchas, que tenían un color amarillo brillante, se rociaron en el aire y las personas expuestas a él ("canarios") maldicieron el ácido pícrico no solo por su poder explosivo, sino también por el sabor cáustico en la boca y la pintura incrustada.
Además del dinitronaftaleno, el dinitrofenol y el trinitrocresol se utilizan para equipar las municiones. Esto les permite equipar municiones de gran calibre. Se utilizan aleaciones de 60% de ácido picrico y 40% de dinitrofenol y de 40% de ácido picrico y 60% de trinitrocresol.
Obtener ácido pícrico del fenol. El fenol se puede nitrar directamente solo con ácidos muy diluidos, lo que es técnicamente difícil y desventajoso. La nitración del fenol con una mezcla ácida, incluso de resistencia media, es casi imposible, ya que la alta velocidad de reacción y, en consecuencia, la liberación intensa de calor provoca su oxidación y tono. Para prevenir estos procesos, la síntesis se divide en dos etapas. En la primera etapa, se obtiene ácido fenol disulfónico, en la segunda etapa, directamente trinitrofenol.
El proceso de sulfonación se acompaña de la liberación de agua, la dilución del ácido sulfúrico y es reversible:
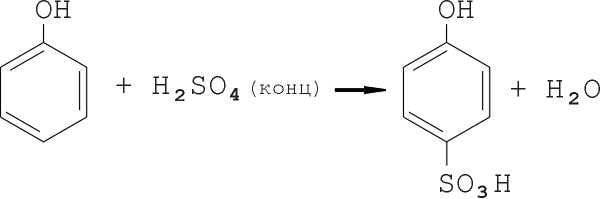
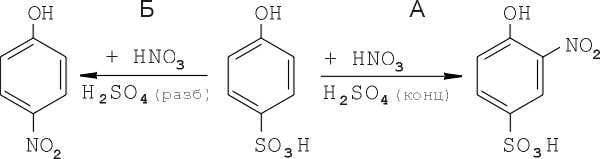
Bajo la acción del ácido fenolsulfónico con ácido nítrico en presencia de un exceso de ácido sulfúrico concentrado, uno de los hidrógenos en el núcleo se reemplaza por un grupo nitro (Proceso A); en presencia de ácido sulfúrico diluido, el grupo sulfo se reemplaza por el grupo nitro (proceso B):
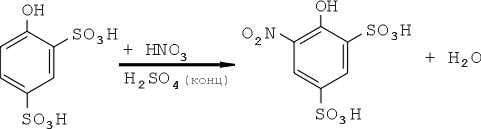
Por lo tanto, con la introducción de tres grupos nitro en la molécula de fenol, es más conveniente llevar a cabo el proceso en el siguiente orden. Primero, el fenol disulfónico se obtiene del fenol en dos etapas, luego se agrega una mezcla de ácidos sulfúrico concentrado y nítrico a la mezcla de reacción:
Y, finalmente, el compuesto bastante complejo obtenido se convierte en trinitrofenol en medio de ácido sulfúrico diluido:
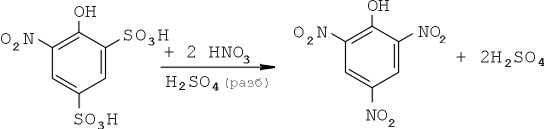
El agua liberada en este caso no es un obstáculo molesto, pero (¡rara vez!) Un factor muy importante: diluye el medio de reacción ajustando automáticamente la concentración de ácido sulfúrico.
En este caso, cuando se recibe ácido pícrico del ácido fenolsulfónico, no se requiere circulación de ácido. La mezcla ácida más concentrada se necesita aquí al comienzo del proceso para la introducción del primer grupo nitro, y en la mezcla nitrosa subsiguiente se diluye con agua evolucionada, lo que hace que el medio sea adecuado para reemplazar el grupo sulfo con el grupo nitro. La nitración se produce en las condiciones más favorables, en un medio homogéneo, ya que los ácidos sulfónicos y sus derivados nitro se disuelven bien en el ácido sulfúrico. Al final del proceso, los cristales de trinitrofenol [5] significativamente menos solubles se caen. El producto resultante se exprime del ácido, se lava con agua y se seca.
La síntesis es bastante simple, al igual que la síntesis de nitroglicerina, pero el producto resultante es mucho menos susceptible al riesgo de una explosión. El modo de temperatura se mantiene debido al calor liberado durante la reacción (indudablemente más), y la concentración de ácido se mantiene automáticamente diluyendo el agua formada (solo una rara suerte, la coincidencia de las direcciones de los dos procesos). Tal simplicidad de la tecnología ha permitido obtener enormes cantidades de ácido pícrico. Pero después de 10 años de uso, el ácido pícrico fue completamente reemplazado por un tolom neutral, más conveniente y más seguro a principios del siglo XX. Sin embargo, tanto en 1 World War como en 2 World War, cuando no había necesidad de preocuparse por la seguridad de las municiones durante el almacenamiento, y los depósitos de la fábrica iban directamente al frente, la producción de “picrings” se reanudó y alcanzó enormes tamaños. A partir del año 1943, cuando se recuperaron las existencias de conchas de antes de la guerra y los recursos de los alemanes, comenzaron a equipar tanto las minas como las conchas y granadas con "picrinke" en lugar de tola.
En este punto de la narrativa, parece más apropiado comenzar a hablar de una competencia práctica completamente no planificada de ácido pícrico en su encarnación japonesa con piroxilina como un explosivo explosivo durante la infame guerra ruso-japonesa, pero el autor no hará esto conscientemente: toneladas de papel y terabytes de recursos informáticos. dedicado a este problema, y no puso un punto final en este problema. Yo, tal vez, me abstendré ...
TNT, él es tol
La palma en el descubrimiento del trinitrotolueno debe darse a los alemanes. Fue el representante de Alemania Julius Wilbrandt en 1863 quien recibió trinitrotolueno por primera vez. La historia posterior de los futuros explosivos se desarrolló más rápidamente que la del ácido pícrico. Ya en 1887, el departamento militar prusiano se interesó por él como un posible sustituto del ácido pícrico en los proyectiles de artillería.
Sin embargo, tuvo poco éxito. Sólo a principios del siglo XX, gracias al trabajo del ingeniero alemán G. Caste, encontró uso en los asuntos militares. Y en 1902, bajo el nombre oficial de "FulIpuIver-2" (y no oficial, encriptado "TNT"), el ejército alemán adoptó el trinitrotolueno técnicamente puro como un relleno para los proyectiles de artillería de pequeño calibre. Y en Alemania, y en muchos otros países, el trotilo fue considerado un invento alemán.
En Francia, creía lo contrario. En Rusia, también.
Hay un documento notable que le permite mirar la historia del desarrollo e implementación de trotyl con diferentes ojos. Aquí están los fragmentos de este documento.
Sobre el uso de explosivos en el equipamiento de carcasas en países extranjeros.
Para informar a los guardias. Personal Capital Rdultovskogo en viajes al extranjero en 1906
Reporte No. 7 / 1906
Durante mi estancia en el extranjero a principios de este año, pude recopilar, independientemente de la tarea que se me encomendó, información sobre el uso de explosivos en proyectiles de artillería en varios estados.
... 8. Alguna información sobre el trinitrotolueno. Cuando estuve en Alemania, tuve que escuchar que en la artillería alemana se estaba probando algún tipo de equipo de proyectil, conocido como "TNT". Pronto fue posible descubrir que este es el nombre en clave para el trinitrotolueno, fabricado por la fábrica de la empresa Carbonite cerca de Colonia. Cuando visité esta fábrica, pude familiarizarme en general con la preparación de "TNT", pero la fábrica se negó a brindarme información más detallada, explicando esto por el retraso en la emisión de una patente. Recibí una explicación similar en otra fábrica, la Sociedad Angalto-Westfalia.
... A mi llegada a Francia, en una entrevista con el Sr. Viel, le pregunté su opinión sobre el trinitrotolueno y recibí la respuesta de que este explosivo es en sí muy bueno, pero que en la actualidad las fábricas francesas no producen su producto original, el tolueno.
... en Inglaterra, en la planta de la Compañía Nobel ... resultó que el Sr. Viel ha insistido durante mucho tiempo en estudiar las propiedades y métodos de fabricación de derivados nitro más altos ... "
Notamos un punto importante: el irreprimible Viel, que intentó en repetidas ocasiones obtener patentes para obtener explosivos (la historia sobre él, como muchos otros personajes de esta historia, merece una publicación por separado, que será preparada por el autor, si los lectores expresan el deseo de leerla). Se sustituye la PC y se intenta introducirla en producción. Vio el principal problema en la falta de suficientes materias primas, pero creo que aquí era un poco astuto: había suficientes problemas con la producción de TNT y apenas estaban empezando a surgir.
Y la pelea fue por eso. Las características del trinitrotolueno (TNT) fueron bastante impresionantes:
1. Sensibilidad: al impacto, fricción, disparo a través de una bala, fuego, chispa, el ataque químico no es sensible (4-8% de explosiones cuando una carga de 10 kg cae desde una altura de 25 cm).
2. Energía de transformación explosiva - 4228 kJ / kg.
3. Velocidad de golpe: 6900 m / s.
4. Brizantnost: 19 mm.
5. Explosividad: cubo 285 ver
No hay nada sorprendente en la facilidad comparativa con la que el joven oficial ruso logró entablar conversaciones sobre el trinitrotolueno e incluso extraer información muy útil de estas conversaciones. Como ya sabe el lector, el trinitrotolueno, como un compuesto químico en los círculos de los químicos y los científicos de artillería, sabía muchas y muchas cosas.
Por lo tanto, cuando se expone a una llama abierta, la TNT se enciende y arde con una llama amarilla altamente humeante. La combustión a presión atmosférica se ve así:
La combustión a alta presión procede de forma algo diferente:
La combustión en un espacio cerrado de una gran cantidad puede convertirse en detonación (teóricamente, en la práctica no ocurre). La detonación es el siguiente proceso:
Pero otra cosa es "TNT", un producto técnico de una industria química en desarrollo, adecuado para fines militares. Ni las fábricas alemanas, ni el centro de investigación Spandau, que también fue visitado por V.I. Rdultovsky, no recibieron información tecnológica.

Secretos cuidadosamente guardados de los arsenales prusianos, los descubrió de forma completamente inesperada ... en Francia. En el desempeño temporal de los deberes del agregado militar ruso aquí (entonces fue llamado sin circunstancia, "agente militar"), el enérgico y emprendedor capitán Conde A.A. Ignatiev fue el mismo que, ya teniente general del ejército soviético, escribió los famosos recuerdos en los que se llevó a cabo cincuenta años. Estoy construyendo ", organizó un viaje a Bourges, el centro de la artillería francesa, para un colega enviado al extranjero.
Los científicos franceses de artillería saludaron calurosamente a su homólogo ruso. Vladimir Iosifovich admitió más tarde a sus familiares y amigos que el vino que los franceses le habían tratado era excelente y que era simplemente una pena tirarlo poco a poco en macetas. Pero después de todo, la conversación resultó ser tan emocionante, ¡sobre el "trotyl"!
Una vez mil años hay tales coincidencias. Literalmente, en vísperas de esta reunión, 30 de abril 1906, el químico principal del principal laboratorio pirotécnico en Bourges, el Dr. Química, teniente coronel de la artillería francesa Koehler recibió en el fondo de su corazón la ira del ministerio militar. El despacho, como escribió V.I. Rdultovsky en su informe a las autoridades, transmitió información de inteligencia sobre el nuevo “trotilo” explosivo, que se probó en Alemania, a gran escala, así como una muestra de esta sustancia. El ministerio recomendó evaluar cuidadosamente la nueva invención alemana. Pero estaba por encima de la fuerza moral del jefe del principal laboratorio pirotécnico.
"Esto no es un invento alemán", exclamó Kohler, quien se había emborrachado, a su colega ruso. "¡Entiende, capitán del personal, no alemán! ¡Este es el logro de Francia!
Como usted entiende, en tal situación no fue difícil inducir a los furiosos propietarios a dar las explicaciones adecuadas. Keller, que era bastante rastepushivshiysya, sin dudarlo, presentó atentamente y con simpatía a su oficial extranjero toda la información que tenía sobre su prioridad en la apertura del trinitrotolueno y los inútiles intentos de interesarle en el ministerio militar de Francia. En conclusión, el químico algo arrugado expresó la esperanza de que ahora el liderazgo del ejército prestará atención a su desarrollo "al menos ahora que ya puede ser adoptado en Alemania ..."
Rdultovsky aprendió muchas cosas esa noche. Y que el químico francés comenzó a realizar extensos experimentos con TNT en 1895. Y sobre los éxitos en la síntesis de laboratorio de explosivos, y al mismo tiempo, sobre algunas características del proceso. Y sobre la inercia de los líderes militares que no querían cambiar nada. Y sobre la omnipresente inteligencia alemana que regularmente le robaba una nota. Pero hubo una cosa más que alarmó especialmente al sonriente y atento capitán del personal: Köhler informó que desde 1905, los alemanes han comenzado los experimentos más amplios sobre el uso de TNT en proyectiles para artillería pesada. Anteriormente, nadie podía usar un poderoso explosivo para equipar proyectiles de gran calibre para pistolas y obuses (los problemas enfrentados por los tecnólogos al usar PC y SC se describieron anteriormente). La información recibida nos permitió concluir que los alemanes consiguieron, si no eran perfectos, un explosivo muy conveniente y efectivo.
La información obtenida por V.I. la flota. Además, llena de drama y problemas, fracasos y éxitos, la historia del TNT ruso también es objeto de un estudio separado. Haremos una nota más: ya en 1907 se tomó una decisión sobre la introducción universal de TNT, y en 1909 comenzó la producción industrial de este explosivo. otros países lo cambiaron solo en 1911-1918.
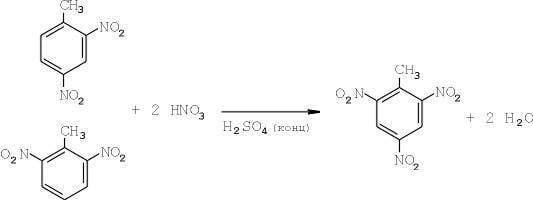
¿Cuál fue la trampa? Como siempre, en el proceso de traducción del laboratorio a las plantas industriales. Como la mayoría de los otros procesos, la nitración del tolueno tiene lugar en tres etapas. En la primera etapa, la producción de mononitrotolueno se produce:
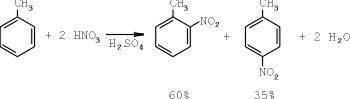
El proceso tarda aproximadamente una hora en la mezcla de reacción de la siguiente composición: ácido sulfúrico - 55%, ácido nítrico - 28% (la cantidad de ácido nítrico debe ser 105% del teórico necesario).
El producto de reacción es mononitrotolueno, un líquido amarillo claro con un punto de fusión de 5 ° C. La salida de mononitrotolueno es 95% de teóricamente posible.
La segunda etapa es la preparación de dinitrotolueno en la mezcla de nitración de la composición: ácido sulfúrico - 67%, ácido nítrico - 23%.
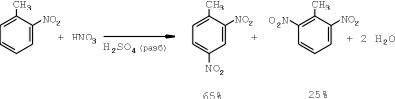
Esta vez, la cantidad de ácido nítrico que se toma para la nitración debe ser 200% del teórico requerido, y el tiempo para el proceso debe ser de aproximadamente 2,5 horas.
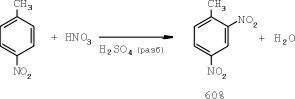
Y, finalmente, la tercera etapa es la preparación del trinitrotolueno directamente (TNT):
Se utiliza una mezcla de nitración de la composición: ácido sulfúrico - 83%, ácido nítrico - 17% [2, 17].
Tiempo para procesar - aproximadamente 1,5 horas. El exceso de ácido nítrico en esta etapa es 100% del teórico necesario. El rendimiento del producto terminado es de hasta 90% [2,3, 17].
¿Cuál es la diferencia entre TNT y ácido pícrico? Según las características principales, prácticamente nada: algunos parámetros son más altos, algunos son más bajos, pero todas las diferencias están, en general, dentro de los límites de error estadístico (consulte la tabla 1).
--------------------------------------------------- -------------------------------------------------- --------------------------------------------
BB ...... Sensibilidad ..... Energía de la explosión ... Velocidad de detonación ... Ampollas ... Alta explosividad
--------------------------------------------------- -------------------------------------------------- --------------------------------------------
ПК.......10/25/24-32....................4020..................7350.........................17...................310
ТНТ......10/25/4-8.......................4228..................6900.........................19...................285
--------------------------------------------------- -------------------------------------------------- --------------------------------------------
Pero con sensibilidad, la situación es mucho más interesante. Y si los problemas con el ácido pícrico ya se han convertido en un libro de texto (¡nuevamente, permítanme recordarle, solo recuerden, no más!) La discusión sobre “piroxilina shimosis VS”, etc.), entonces el trotilo de estos defectos fue completamente privado: 4-8% no es solo una estadística Esto es prácticamente una garantía de manejo seguro de municiones.
¿Y qué pasa con la procesabilidad de los procesos? A primera vista, no hay diferencia en comparación con la nitración del fenol. Sin embargo, tras un examen más detenido, se puede observar que si en el primer caso la concentración de la mezcla nitrosa se regula de forma casi automática, en este caso no existe tal lujo. Y esto significa un hecho simple y triste: cada uno de los productos intermedios debe aislarse y realizarse en nuevas mezclas de reacción.
La separación de las sustancias de las mezclas es uno de los procesos más rechazados por los químicos. En términos de consumo de energía e intensidad de mano de obra, por lo general requiere decenas y cientos de veces más esfuerzo que la mezcla (un ejemplo clásico es la tarea de la Cenicienta, emitida por una astuta madrastra). El tiempo de producción y el costo del producto aumentan muchas veces, la escala de producción también. La solubilidad de los derivados nitro del tolueno en agua es muy baja, pero de los tres productos, solo el mono derivado (la primera etapa) es un líquido más liviano que el agua, lo que facilita su liberación. Los derivados di y trinitro son sólidos y su separación de la fase acuosa requiere mantener la mezcla en 90 - 100 C. Volvamos nuevamente a la tabla comparativa.
--------------------------------------------------- -------------------------------------------------- -----------
BB ..... Consumo de reactivos en 1kg ...... Número de etapas ........ Número
........ Nitrógeno to-ta..Serna to-that ............................... asignado productos
--------------------------------------------------- -------------------------------------------------- -----------
PC ......... 1,4 ................. 2,8 ..................... ..3 ........................... 1
TNT ........ 3,9 ................. 6,3 ...................... .3 ........................... 3
--------------------------------------------------- -------------------------------------------------- -----------
Como se puede ver, con características de combate relativamente iguales de ambos explosivos, los parámetros de producción claramente no estaban a favor de TNT. Este problema solo podría ser resuelto por los estados que tenían dos factores: una industria química desarrollada y un stock relativamente pequeño de PC acumulados hasta ese momento.
¿Cómo se une el nitrógeno?
Por lo tanto, la situación se ha vuelto extremadamente clara: solo los países con grandes cantidades de ácido nítrico barato y una producción químico-tecnológica altamente industrial pueden producir poderosos explosivos. Los líderes indiscutibles a este respecto en la segunda mitad del siglo XIX fueron Inglaterra, Francia y Alemania. Y luego la Primera Guerra Mundial comenzó mucho antes de que los disparos fatales sonaran en Sarajevo.
El problema de la unión al nitrógeno (como en la tecnología química llamada los procesos complejos de conversión del nitrógeno atmosférico en ácido nítrico y sus sales), los químicos han estado desconcertados durante mucho tiempo. Resuélvelo de dos maneras.
La primera fue la oxidación directa de nitrógeno con oxígeno:
Entonces todo parecía simple: primero, el óxido se convertía fácilmente en dióxido
que también se absorbe fácilmente en agua enriquecida con oxígeno para producir ácido nítrico:
Ácido del aire y el agua: Aristóteles se volvería verde de envidia. Parecía que era más simple: encontramos un río adecuado con un flujo rápido, estamos construyendo un complejo único de una central hidroeléctrica y una planta para la producción de ácido nítrico y, voila, el problema se ha resuelto. Pero no siempre lo que se ve en el papel es igual de fácil en la vida.
Como sabes, el diablo se esconde en los detalles. En este caso, tal detalle fue el ícono, uno de los personajes más desagradables de los químicos. Denota el triste hecho de que la reacción se encuentra en un estado de equilibrio dinámico y en cada instante de tiempo el número de moléculas formadas y desintegradas es el mismo. Además, el estado de equilibrio se alcanza muy rápidamente: cuando el contenido de óxido nítrico es aproximadamente 2-3%. Este problema solo se puede prevenir enfriando la mezcla de reacción. En condiciones de laboratorio, fue posible implementar dicho enfoque, pero en condiciones industriales, el rendimiento del producto final se mantuvo deprimentemente bajo. El segundo problema en cuanto a la oxidación directa del nitrógeno fue el consumo excesivo de energía: se consumieron 1 mil kWh por tonelada de producto y solo el 70% de esta energía se gastó en la producción. En general, el nitrógeno atmosférico parecía tan inexpugnable como el dormitorio de la reina.
Pero, como saben, no hay bastiones inaccesibles: si falla un asalto directo, siempre puede encontrar una solución alternativa. Esta maniobra en el tema de la unión al nitrógeno fue la reacción de oxidación del amoníaco:
Sin embargo, la naturaleza perniciosa de la naturaleza fue que la fuente de amoníaco en la naturaleza tampoco existe, aunque los componentes para su producción son los mismos (agua y aire) y están disponibles en cantidades ilimitadas en cualquier parte del planeta.
Es una paradoja, pero la producción de hidrógeno por electrólisis del agua, la síntesis de amoníaco y su oxidación en un arco de descarga eléctrica, tal desvío ha demostrado ser económica y tecnológicamente más rentable y más económica que la oxidación directa del nitrógeno.
Síntesis de amoniaco: la reacción también es reversible, pero el equilibrio se produce cuando el contenido de amoníaco es del orden de 30%. Y aunque también requiere el uso de calor y el aumento de la temperatura, sus condiciones pueden cambiar significativamente en la dirección de facilitar el proceso.
Y aquí nos enfrentamos a una de las páginas más románticas de la lucha de los químicos, que precedió al choque de generales. Otro actor apareció en escena: el catalizador. Son estas sustancias notables, llamadas "varita mágica de la química" de Vant-Hoff las que pueden influir dramáticamente en los procesos químicos.
La búsqueda y adaptación de catalizadores no es una tarea fácil. A menudo, este trabajo puede llevar varios años y nadie puede garantizar el éxito por adelantado.
En Alemania, este problema se elevó al más alto nivel: el propio Kaiser supervisó personalmente la búsqueda de un proyecto catalizador. El problema se resolvió con la minuciosidad y la puntualidad alemana. A los químicos se les encomendó la tarea, ni menos ni menos, sino desarrollar una teoría de la acción de los catalizadores y, basándose en ella, encontrar la más efectiva para la reacción de producción de amoníaco. Para estos trabajos, se asignó una cantidad impensable para esos tiempos - marcas 100000, y se estableció un período de dos años. Pero dos años de duro trabajo terminaron en fracaso. Luego, el Kaiser asigna nuevamente las marcas 50000 de la tesorería y le asigna la tarea en un año para encontrar un catalizador adecuado por experiencia. Con la pedantería propia de los alemanes, los científicos han analizado a través de 250 miles de materiales diferentes: sustancias simples y complejas, mezclas y aleaciones, líquidos, sólidos y gases. El catalizador que encontraron en 1908, una aleación de platino con iridio o rodio, a pesar de que ahora se han encontrado análogos más baratos, todavía funciona regularmente en muchas plantas químicas (mirando hacia adelante, diré que los químicos alemanes Fritz Haber en 1918 y Karl Bosch, quien mejoró enormemente este proceso en 1931, recibió los Premios Nobel por su investigación).
Pero eso fue todo más tarde, después de Versalles y la nueva ronda de militarización de Alemania. Y luego Alemania mantuvo su secreto, no peor que el de los Cruzados del Santo Grial. Los trabajos sobre la síntesis de amoníaco se transfieren de los laboratorios de Karlsruhe a la compañía de anilina-soda de Baden (fue allí donde K. Bosch se unió al trabajo). En el año 1910, BASF implementó e implementó completamente la tecnología de amoníaco y ácido nítrico; en 1913, se construyó una fábrica en Oppau, ya durante la guerra, en Lane. A comienzos de la segunda década del siglo XX, las fábricas alemanas cubrieron completamente las necesidades de arsenales para explosivos y agricultores para fertilizantes nitrogenados. En el caso de la movilización de la fábrica podría dar las enormes cantidades de explosivos y polvos necesarios para la guerra a gran escala. Y todo esto sin suministros externos, exclusivamente sobre materias primas nacionales (como se sabe, el aire está en todas partes doméstico). Los chilenos consideraron las pérdidas, los almirantes ingleses fumaron nerviosamente al margen, sus escuadrones blindados ya no eran el garante de la paz mundial (más precisamente, el orden mundial inglés). Y en este momento en Potsdam, los generales planearon conquistar el mundo (otro vértigo por el éxito). Ahora, gracias a Haber, los explosivos necesarios para la guerra eran ilimitados.
En nuestro mundo, todo está interconectado. Y casi nada se da por sentado. Excepto, quizás, una cosa: la importancia eterna de la ciencia. El autor no quiere parecerse a ese cuaderno, flotando en voz alta en su pantano, pero al estudiar la historia del mundo y la historia de la ciencia lo convence de que los países cuyos líderes prestaron atención al desarrollo de las ciencias básicas, sin exigirles que tengan un efecto práctico inmediato, siempre se beneficiaron de ello. La forma de una solución rápida a problemas urgentes. Y la química, como una de las ciencias más antiguas y sorprendentes, pertenece a uno de los lugares más destacados.
Y el nitrógeno y sus compuestos no recibieron renuncia luego de la transición a TNT. Además, hoy, con el abandono gradual del otrora tola popular, domestican regularmente al diablo de los explosivos con explosivos aún más potentes: el hexógeno y el octógeno. Y recientemente en la prensa hubo informes de la síntesis de un nuevo explosivo explosivo, que afirmaba estar incluido en la lista de élite de los explosivos más populares del mundo. Esto es hexanitrohexaazaisowurtzitane, conocido con el nombre comercial CL-20. Su molécula es una obra maestra de la química sintética, que representa un diseño a cielo abierto de dos pentágonos en los que los átomos de nitrógeno son más grandes que los átomos de carbono.
Así que la historia militar del nitrógeno y los nitratos continúa ...
Literatura
1. http://wap.alternativa.borda.ru/?1-5-120-00000316-000-0-0-1140073895.
2. http://www.pirotek.info/VV/Sintez_TNT.html.
3. http://www.exploders.info/sprawka/40.html.
4. HiMiK.ru. http://www.xumuk.ru/encyklopedia/2/4574.html.
5. http://rudocs.exdat.com/docs/index-34762.html?page=17.
6. http://army.armor.kiev.ua/engenear/dinamit.shtml.
7. http://www.pirotek.info/Vv2/nitroglicol.htm.
8. http://www.exploders.info/sprawka/91.html.
9. A. Shtetbacher. Pólvora y explosivos. Moscú: ONTI - Principales editores de literatura química, 1936.
10. L.V. Dubnov, N.S. Baharevich, A.I. Romanov. Explosivos industriales. Moscú, Nedra, 1988.
11. F. Naum. Explosivos de nitroglicerina y nitroglicerina. Moscú - Leningrado: Editorial Técnica Estatal de Químicos ONTI, 1934.
12. http://war.newru.org/news/dinamitnye_pushki_zalinskogo/2012-11-24-88.
13. http://piterhunt.ru/pages/nk-os/3/3.htm.
14. Stanitsyn V. La pólvora // Química y vida. 1975. No.10. C. 48-54.
15. http://igor-grek.ucoz.ru/publ/tekhnologii/vzryvchatka_pikrinovaja_kislota/7-1-0-156.
16. http://dic.academic.ru/dic.nsf/ruwiki/104953.
17. Demidov V.I. Miel Amarga - Melinita // Química y Vida. 1974. No.8. Con 61-65.
18. Orlova E.Yu. Química y tecnología de los altos explosivos. 3 ed. reclamando L .: Química, 1981. 312 con.
información